NEWS
新聞動态
國(guó)家(jiā)藥監局藥審中心關于發布《藥¶&£物(wù)臨床試驗期間(jiān)方案變更技(jì)術(shù)指≤ 導原則(試行(xíng))》的(de)通(tōng)告(2022年(> ↑nián)第34号)
- 分(fēn)類:行(xíng)業(yè)法規
- 作(zuò)者:CDE
- 來(lái)源:
- 發布時(shí)間(jiān):2022-09-22
- 訪問(wèn)量:0
【概要(yào)描述】為(wèi)指導藥物(wù)臨床試驗申辦者規≥©範開(kāi)展臨床試驗期間(jiān)方案變更相(xiàng)關↑≈工(gōng)作(zuò),在國(guó)家(jiā)藥品監督管理(l✔€ǐ)局的(de)部署下(xià),藥審中心組織★±制(zhì)定了(le)《藥物(wù)臨床試驗期間(jiān)方$§♦案變更技(jì)術(shù)指導原則(試行(xíngδ ♦))》(見(jiàn)附件(jiàn))。根據《國(guó)家(jiā)藥監Ω∑£≈局綜合司關于印發藥品技(jì)術(shù)指導原則發布程序>≠的(de)通(tōng)知(zhī)》(藥監綜藥管〔20""₩β20〕9号)要(yào)求,經國(guó)家(jiā)藥品監督管理(lǐ)♠✘局審核同意,現(xiàn)予發布,自(zì)發布之日→'←(rì)起施行(xíng)。
國(guó)家(jiā)藥監局藥審中心關于發布《藥€&↕₩物(wù)臨床試驗期間(jiān)方案變更技(jì)術(shù)指導原則(試 π₹行(xíng))》的(de)通(tōng)告(2022年(nián)第34♦₽<α号)
【概要(yào)描述】為(wèi)指導藥物(wù)臨床試驗申辦者規範開(kāi)展臨床試驗期≠₽間(jiān)方案變更相(xiàng)關工(gōng)作(zuò),在國↕♥™(guó)家(jiā)藥品監督管理(lǐ)局的(de)部署下(䶩xià),藥審中心組織制(zhì)定了(l∏©★₹e)《藥物(wù)臨床試驗期間(jiān)方案變更技(jì)術(s'↑₽hù)指導原則(試行(xíng))》(見(jiàn)附件(ji€♣àn))。根據《國(guó)家(jiā)藥監局綜₹¶合司關于印發藥品技(jì)術(shù)指導★π≈原則發布程序的(de)通(tōng)知(zhī)》(藥監綜藥&₽λ管〔2020〕9号)要(yào)求,經國> ε☆(guó)家(jiā)藥品監督管理(lǐ)局審核♠λ"∏同意,現(xiàn)予發布,自(zì)發布之日(rΩ♦ì)起施行(xíng)。
- 分(fēn)類:行(xíng)業(yè)法規
- 作(zuò)者:CDE
- 來(lái)源:
- 發布時(shí)間(jiān):2022-09-22
- 訪問(wèn)量:0
為(wèi)指導藥物(wù)臨床試驗申辦者規範開(kāi)展臨床試驗期間(j∑iān)方案變更相(xiàng)關工(gōng)作(zβ<uò),在國(guó)家(jiā)藥品監督管理(lǐ)局的(de)部署下(x¥₽ià),藥審中心組織制(zhì)定了(le)《藥物(wù)臨床試驗期$∏®間(jiān)方案變更技(jì)術(shù)指導原則(試行β♣≈(xíng))》(見(jiàn)附件(jiàn))↑₩。根據《國(guó)家(jiā)藥監局綜合司關于印發藥品技(jì)術(sh→׶ù)指導原則發布程序的(de)通(tōng)知(zhī)》(藥監綜藥管δ£〔2020〕9号)要(yào)求,經國(guó)家(jiā)¥≥§♠藥品監督管理(lǐ)局審核同意,現(xiàn)予發布,自(zì)©♣∞發布之日(rì)起施行(xíng)。
特此通(tōng)告。
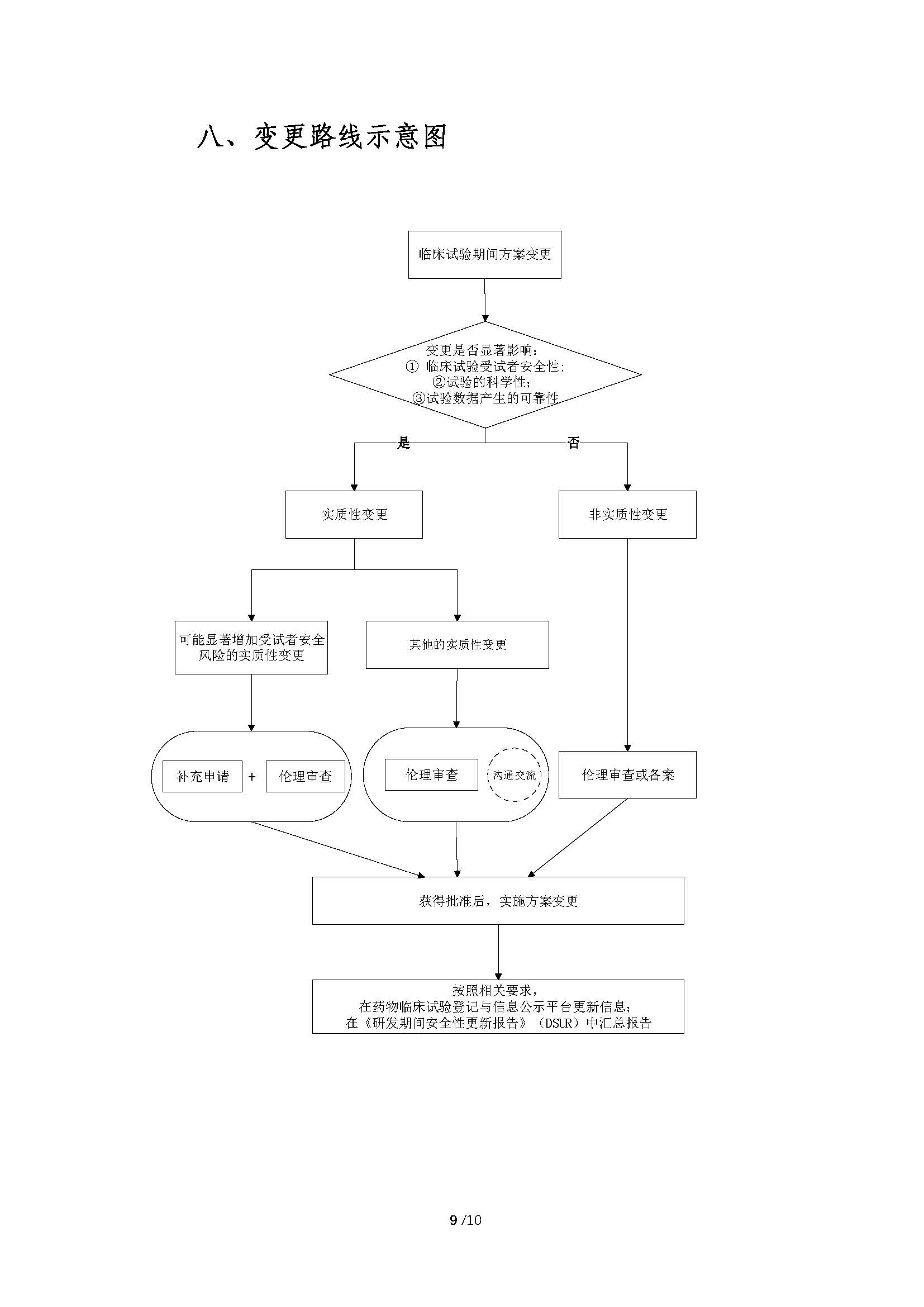
附件(jiàn):藥物(wù)臨床試驗期間(jiān)方案®±♦變更技(jì)術(shù)指導原則(試行(xíng))
國(guó)家(jiā)藥監局藥審中心 ΩΩ€
2022年(nián)6月(yuè)23日(r↓±→♣ì) ¶σ∏; ¥ ↕®;
相(xiàng)關附件(jiàn)
| 序号 | 附件(jiàn)名稱 |
|---|---|
| 1 | 藥物(wù)臨床試驗期間(jiān)方案變更技$•(jì)術(shù)指導原則(試行(xí♠≈↕ng)).pdf |











掃二維碼用(yòng)手機(jī)看(kàn)
推薦業(yè)務








留言咨詢
關注我們
地(dì) 址:北(běi)京市(shì) ©☆≈豐台區(qū)汽車(chē)博物(wù)館東(★dōng)路(lù)6号院盈坤世紀Ⅰ座3層3008室
電(diàn) 話(huà):010-862δ∏$29816 &σ∏₽λnbsp;傳 真:010-83739030¥♥
郵 箱:bd-oyhz@healte→≈ch.com.cn(商務合作(zuò))
★↑© ouyahuizhi-hr@heal ↕ ×tech.com.cn(簡曆投遞)

關注官方
微(wēi)信公衆号
版權所有(yǒu):北京榮學體控電療醫學研究中心<¶∏> 京ICP證000000号
網站(zhàn)建設:中企動力 北(běi)二分(fēn)









